Avtor:
Monica Porter
Datum Ustvarjanja:
22 Pohod 2021
Datum Posodobitve:
27 Junij 2024
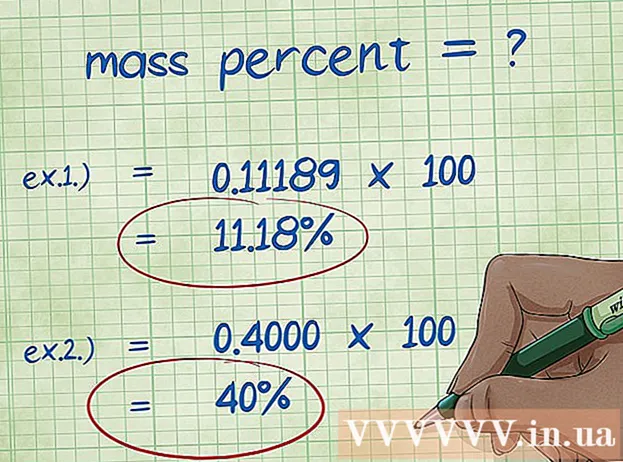
Vsebina
Masni odstotek označuje odstotek vsakega elementa v kemični spojini. Da bi našli masni odstotek, moramo poznati molsko maso elementov v spojini v gramih / mol ali število gramov snovi, ki tvorijo raztopino. Masni odstotek se izračuna po preprosti formuli, ki deli maso elementa (ali topljene snovi) z maso spojine (ali raztopine).
Koraki
Metoda 1 od 2: Izračunajte masni odstotek znane mase
Določite enačbo za odstotek mase v mešanici. Osnovna formula za izračun masnega odstotka v mešanici je: masni odstotek = (kakovostna masa / mešana masa) x 100. Končno morate pomnožiti s 100, da predstavljate odstotek.
- Na začetku enačbe napišite enačbo: masni odstotek = (masa snovi / mešana masa) x 100.
- Količina kakovosti bo podana v problemu. Če tema ni navedena, si oglejte naslednji odsek, kako najti masne odstotke, ne da bi poznali uteži.
- Masa zmesi je enaka skupni masi snovi, ki sestavljajo zmes ali raztopino.

Izračunajte maso zmesi. Ko poznate maso elementov ali spojin, jih morate le sešteti, da dobite maso končne mešanice ali raztopine. To je imenovalec v formuli odstotka mase.- Primer 1: Kolikšen je masni odstotek 5 g natrijevega hidroksida, ko ga raztopimo s 100 g vode?
- Masa zmesi je skupna masa natrijevega hidroksida in vode: 100g + 5g. Mešana teža je torej 105 g.
- 2. primer: Izračunajte maso natrijevega klorida in vode, potrebne za 175 g 15% raztopine?
- V tem primeru, kjer poznate mešano maso in masni odstotek, naloga zahteva najti maso dodane topljene snovi. Masa mešanice je 175 g.
- Primer 1: Kolikšen je masni odstotek 5 g natrijevega hidroksida, ko ga raztopimo s 100 g vode?

Določite maso snovi, da dobite odstotek mase. Ko kviz zahteva, da poiščete "masni odstotek" snovi, morate maso snovi najti kot odstotek skupne mase vseh sestavin. Zapišite maso snovi in poiščite odstotek mase. To je števec v formuli za maso v odstotkih.- Primer 1: Masa natrijevega hidroksida (snov, ki jo najdemo z masnim deležem) je 5 g.
- Primer 2: V tem primeru količina snovi išče odstotek neznane mase, vi pa iščete.

Zamenjajte spremenljivke z enačbo masnih odstotkov. Ko določite vrednost vsake spremenljivke, jih preprosto vključite v enačbo.- Primer 1: masni odstotek = (masa snovi / mešana masa) x 100 = (5 g / 105 g) x 100.
- Primer 2: Za izračun količine neznane kakovosti moramo pretvoriti enačbo mase v odstotkih: masa mase = (odstotek mase * mešana masa) / 100 = (15 * 175) / 100 .
Izračunajte količinski odstotek. Zdaj, ko je enačba izpolnjena, morate izračunati le masni odstotek. Maso snovi razdelite na maso zmesi, nato pa jo pomnožite s 100. To je masni odstotek snovi v zmesi.
- Primer 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Zato je masni odstotek 5 g natrijevega hidroksida, raztopljenega v 100 g vode, 4.761%.
- Primer 2: Enačba po pretvorbi za izračun količine kakovosti je (odstotek mase * mešana teža) / 100: (15 * 175) / 100 = (2625) / 100 = 26,25 grama natrijev klorid.
- Teža dodane vode je masa zmesi minus teža snovi: 175 - 26,25 = 148,75 grama vode.
Metoda 2 od 2: Izračunajte masni odstotek, kadar masa ni znana
Določite enačbo za odstotek mase v spojini. Osnovna formula za izračun masnega odstotka v spojini je: masni odstotek = (elementarna molska masa / molska masa spojine) x 100. Elementarna molska masa je masa enega mola elementa medtem ko je molekulska masa masa enega mola spojine. Na koncu morate pomnožiti s 100, da dobite odstotno vrednost.
- Na začetku enačbe napišite enačbo: masni odstotek = (elementarna molska masa / molska masa spojine) x 100.
- Enoti zgornjih dveh vrednosti so grami na mol (g / mol).
- Kadar težava ne daje mase, lahko z molsko maso izračunate masni odstotek elementa.
- Primer 1: Izračunajte masni odstotek vodika v molekuli vode.
- 2. primer: Izračunajte masni odstotek ogljika v molekuli glukoze.
Napiši Kemična formula. Če težava ne zajema kemijskih formul za vsako spojino, jih boste morali zapisati. Če je težava v kemijski formuli, preskočite ta korak in pojdite na korak "Poiščite maso vsakega elementa".
- Primer 1: Napišite kemijsko formulo za vodo, H2O.
- Primer 2: Napišite kemijsko formulo za glukozo, C6H12O6.
Poiščite maso vsakega elementa v spojini. Poiščite molekulsko maso vsakega elementa v kemijski formuli v periodnem sistemu. Elementarna masa je običajno zapisana pod kemijskim simbolom. Zapišite maso vsakega elementa v spojini.
- Primer 1: Ugotovimo lahko, da je masni atom kisika 15.9994; in kubični atom vodika je 10079.
- Primer 2: Ugotovili smo, da je masni atom ogljika 12.0107; kisik je 15.9994; in vodik je 1,0079.
Pomnožite kubični atom z molskim razmerjem. Določite število molov (molsko razmerje) vsakega elementa v kemični spojini. Molsko razmerje se izračuna z majhnim številom spodaj v kemijski formuli spojine. Pomnožite kubični atom vsakega elementa z molskim razmerjem.
- Primer 1: Vodik ima indeks dva, kisik pa indeks 1. Pomnožite torej molekulsko maso vodika z 2, 1 00794 X 2 = 2,01588; in molekulska masa kisika je 15.9994 (pomnoženo z eno).
- Primer 2: Ogljik ima indeks 6, vodik je 12 in kisik je 6. Kubični atom vsakega elementa pomnožite s spodnjim indeksom.
- Ogljik (12,0107 * 6) = 72,0642
- Vodik (1,00794 * 12) = 12,09528
- Kisik (15,9994 * 6) = 95,9964
Izračunajte skupno maso spojine. Dodajte mase vseh elementov v spojini. Skupno maso spojin lahko izračunate z masami, izraženimi v molskih razmerjih. To število bo imenovalec v enačbi odstotka mase.
- Primer 1: Na 15.9994 g / mol (masa enega mola atomov kisika) dodajte 2.01588 g / mol (masa dveh molov atomov vodika) in dobite 18.01528 g / mol.
- Primer 2: Sestavite vse uteži skupaj: ogljik + vodik + kisik = 72,0642 + 12,09528 + 95,9964 = 180,156 g / mol.
Določite osnovno maso, na katero naj se izračuna masni odstotek. Ko problem zahteva "masni odstotek", to pomeni, da morate najti maso določenega elementa v spojini kot odstotek skupne mase vseh elementov. Določite in zapišite maso elementa. Ta masa je masa, izražena v molskem razmerju. To število je števec enačbe odstotka mase.
- Primer 1: Masa vodika v spojini je 2.01588 g / mol (masa dveh molov atomov vodika).
- Primer 2: Masa ogljika v spojini je 72.0642 g / mol (masa šestih molov atomov ogljika).
Zamenjajte spremenljivke z enačbo masnih odstotkov. Po določitvi vrednosti vsake spremenljivke jih preprosto nadomestite z enačbo, opredeljeno v prvem koraku: odstotna masa = (elementarna molska masa / molska masa spojine) x 100 .
- Primer 1: masni odstotek = (molska molekulska masa / molska masa spojine) x 100 = (2,1588 / 18,1528) x 100.
- Primer 2: masni odstotek = (molska elementarna mola / molska masa spojine) x 100 = (72,0642 / 180,156) x 100.
Izračunajte količinski odstotek. Zdaj, ko je enačba izpolnjena, morate izračunati le masni odstotek. Maso elementa delite s skupno maso spojine, nato pa jo pomnožite s 100. To je odstotek mase elementa v spojini.
- Primer 1: masni odstotki = (2,01588 / 18,01528) x 100 = 0,111189 x 100 = 11,18%. Zato je masni odstotek atoma vodika v molekuli vode 11,18%.
- Primer 2: masni odstotek = (elementarna molska masa / molska masa spojine) x 100 = (72,0642 / 180,156) x 100 = 0,4000 x 100 = 40,00%. Tako je masni odstotek ogljikovega atoma v molekuli glukoze 40,00%.