Avtor:
Eugene Taylor
Datum Ustvarjanja:
12 Avgust 2021
Datum Posodobitve:
22 Junij 2024
Vsebina
- Stopati
- 1. del od 2: Normalna elektronska konfiguracija elementa
- 2. del 2: Konfiguracija elektronov žlahtnega plina
- Opozorila
Zapis elektronske konfiguracije za element je dober način za pregled porazdelitve elektronov v atomu. Formula je lahko zelo dolga, odvisno od elementa. Zato so znanstveniki razvili stenografsko notacijo, ki z žlahtnim plinom predstavlja elektrone, ki niso valentni elektroni. To poenostavi elektronsko konfiguracijo in olajša razumevanje kemijskih lastnosti elementa.
Stopati
1. del od 2: Normalna elektronska konfiguracija elementa
 Določite število elektronov v elementu. Atomska številka elementa vam pove število protonov, ki jih ima. Ker imajo elementi v nevtralnem stanju enako število protonov in elektronov, lahko uporabite tudi atomsko število kot število elektronov, ki jih ima element. Atomska številka, ki jo najdete v periodnem sistemu, je številka neposredno nad simbolom elementa.
Določite število elektronov v elementu. Atomska številka elementa vam pove število protonov, ki jih ima. Ker imajo elementi v nevtralnem stanju enako število protonov in elektronov, lahko uporabite tudi atomsko število kot število elektronov, ki jih ima element. Atomska številka, ki jo najdete v periodnem sistemu, je številka neposredno nad simbolom elementa. - Na primer, simbol za natrij je Na. Atomsko število Na je 11.
 Znanje o elektronskih lupinah in nivojih energije. Prva elektronska lupina ima le energijsko raven s, druga elektronska lupina ima energijsko raven s in p. Tretja elektronska lupina ima energijsko raven s, p in d. Četrta elektronska lupina ima raven energije s, p, d in f. Obstajajo več kot štiri elektronske lupine, a v srednji kemijski šoli boste na splošno naleteli le na prve štiri.
Znanje o elektronskih lupinah in nivojih energije. Prva elektronska lupina ima le energijsko raven s, druga elektronska lupina ima energijsko raven s in p. Tretja elektronska lupina ima energijsko raven s, p in d. Četrta elektronska lupina ima raven energije s, p, d in f. Obstajajo več kot štiri elektronske lupine, a v srednji kemijski šoli boste na splošno naleteli le na prve štiri. - Vsak nivo energije s lahko vsebuje do 2 elektrona.
- Vsak p nivo energije lahko vsebuje do 6 elektronov.
- Vsak d nivo energije lahko vsebuje do 10 elektronov.
- Vsak nivo energije f lahko vsebuje do 14 elektronov.
 Spoznajte pravila polnjenja elektronov. Po Aufbaujevem principu morate dodati elektrone na najnižjo raven energije, preden lahko elektron dodate na višjo raven energije. Vsak nivo energije ima lahko več suborbitalov, vendar lahko vsak suborbital hkrati zadrži do dva elektrona. Energijska raven s ima en suborbital, p ima 3 suborbitale, d ima 5 suborbitalov in f ima 7 suborbitalov.
Spoznajte pravila polnjenja elektronov. Po Aufbaujevem principu morate dodati elektrone na najnižjo raven energije, preden lahko elektron dodate na višjo raven energije. Vsak nivo energije ima lahko več suborbitalov, vendar lahko vsak suborbital hkrati zadrži do dva elektrona. Energijska raven s ima en suborbital, p ima 3 suborbitale, d ima 5 suborbitalov in f ima 7 suborbitalov. - Raven d energije ima nekoliko višjo energijo kot nižja raven energije elektronske lupine, zato je verjetnost, da se bo višja energija s napolnila, nižja od nižje ravni d energije. Za pisanje elektronske konfiguracije to pomeni, da bo videti tako: 1s2s2p3s3p4s3d.
 Za zapisovanje konfiguracij elektronov uporabite graf diagonalne konfiguracije. Najlažji način, kako si zapomniti, kako se elektroni polnijo, je uporaba konfiguracijske sheme. V to si zapišete vsako lupino in nivo energije. Narišite diagonalne črte od zgornjega desnega do spodnjega levega dela vsake vrstice. Shema konfiguracije je naslednja:
Za zapisovanje konfiguracij elektronov uporabite graf diagonalne konfiguracije. Najlažji način, kako si zapomniti, kako se elektroni polnijo, je uporaba konfiguracijske sheme. V to si zapišete vsako lupino in nivo energije. Narišite diagonalne črte od zgornjega desnega do spodnjega levega dela vsake vrstice. Shema konfiguracije je naslednja: - 1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p - Na primer: Elektronska konfiguracija natrija (11 elektronov) je: 1s2s2p3s.
- 1s
 Določite zadnjo orbitalo posamezne konfiguracije. Z ogledom periodnega sistema lahko določite, katera bo zadnja podlupina in zadnji nivo energije v elektronski konfiguraciji. Najprej določite, v kateri blok pade element (s, p, d ali f). Nato preštejte, v kateri vrstici je element. Na koncu preštejte, v katerem stolpcu je element.
Določite zadnjo orbitalo posamezne konfiguracije. Z ogledom periodnega sistema lahko določite, katera bo zadnja podlupina in zadnji nivo energije v elektronski konfiguraciji. Najprej določite, v kateri blok pade element (s, p, d ali f). Nato preštejte, v kateri vrstici je element. Na koncu preštejte, v katerem stolpcu je element. - Na primer, natrij je v bloku s, zato je zadnja orbita njegove elektronske konfiguracije s. Je v tretji vrstici in prvem stolpcu, tako da je zadnja orbita 3s. To je dober način, da preverite svoj končni odgovor.
- Pravilo je za d orbitalo nekoliko drugačno. Prva vrstica elementov d-bloka se začne v četrti vrstici, vendar morate od številke vrstice odšteti 1, ker imajo ravni s nižjo energijo kot ravni d. Na primer: vanadij se konča v 3d.
- Drug način preverjanja svojega dela je seštevanje vseh nadpisov. Biti morajo enaki številu elektronov v elementu. Če imate premalo ali preveč elektronov, premislite o svojem delu in poskusite znova.
2. del 2: Konfiguracija elektronov žlahtnega plina
 Določite elektronsko konfiguracijo žlahtnega plina. Konfiguracija elektronov žlahtnega plina je nekakšen okrajšani način zapisovanja celotne elektronske konfiguracije elementa. Stenografija žlahtnega plina se uporablja za povzetek elektronske konfiguracije elementa, hkrati pa zagotavlja najpomembnejše informacije o valentnih elektronih tega elementa.
Določite elektronsko konfiguracijo žlahtnega plina. Konfiguracija elektronov žlahtnega plina je nekakšen okrajšani način zapisovanja celotne elektronske konfiguracije elementa. Stenografija žlahtnega plina se uporablja za povzetek elektronske konfiguracije elementa, hkrati pa zagotavlja najpomembnejše informacije o valentnih elektronih tega elementa. - Plemeniti plin je nadomeščen in predstavlja vse elektrone, ki niso valentni elektroni.
- Plemeniti plini so helij, neon, argon, kripton, ksenon in radon in so v zadnjem stolpcu periodnega sistema.
 Določite žlahtni plin v obdobju za vaš element. Obdobje elementa je vodoravna vrstica, v kateri je element. Če je element v četrti vrstici periodnega sistema, je v četrtem obdobju. Plemeniti plin, ki ga boste uporabljali, je v tretjem obdobju. Spodaj je seznam žlahtnih plinov in njihovih obdobij:
Določite žlahtni plin v obdobju za vaš element. Obdobje elementa je vodoravna vrstica, v kateri je element. Če je element v četrti vrstici periodnega sistema, je v četrtem obdobju. Plemeniti plin, ki ga boste uporabljali, je v tretjem obdobju. Spodaj je seznam žlahtnih plinov in njihovih obdobij: - 1: Helij
- 2: Neon
- 3: Argon
- 4: Kripton
- 5: Ksenon
- 6: Radon
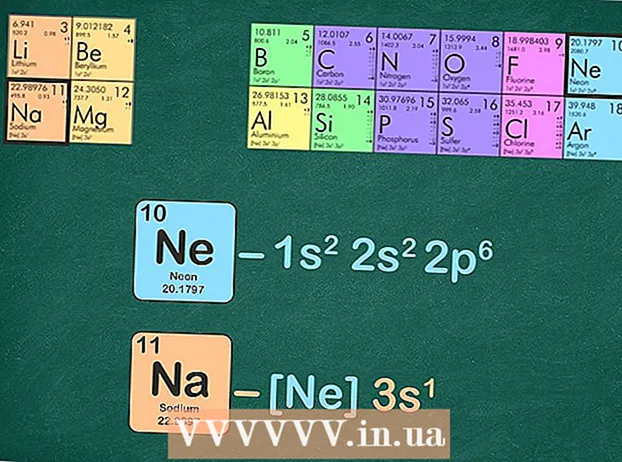
- Na primer, natrij je v 3. obdobju. Za konfiguracijo žlahtnega plina bomo uporabili neon, ker je v 2. obdobju.
 Plemeniti plin zamenjajte z enakim številom elektronov, kot ga ima plemeniti plin. Naslednji korak je nekaj načinov. Izpišete lahko elektronsko konfiguracijo žlahtnega plina in nato isto konfiguracijo zamenjate v elementu, ki vas zanima. Druga možnost je odstraniti enako število elektronov, kot jih ima žlahtni plin, iz elementa, za katerega pišete konfiguracijo.
Plemeniti plin zamenjajte z enakim številom elektronov, kot ga ima plemeniti plin. Naslednji korak je nekaj načinov. Izpišete lahko elektronsko konfiguracijo žlahtnega plina in nato isto konfiguracijo zamenjate v elementu, ki vas zanima. Druga možnost je odstraniti enako število elektronov, kot jih ima žlahtni plin, iz elementa, za katerega pišete konfiguracijo. - Na primer, natrij ima 11 elektronov, neon pa 10 elektronov.
- Polna konfiguracija elektronov za natrij je: 1s22p3s in neon 1s22p. Kot lahko vidite, ima natrij 3s, neon pa ne - zato konfiguracija plemenitega plina za natrij postane [Ne] 3s.
- Lahko pa tudi štejete nadpise ravni energije, dokler jih ne dobite deset. Odstranite te ravni energije in kaj šele, kaj ostane. Če z neonom pišete elektronsko konfiguracijo natrija, vam ostane en elektron: [Ne] 3s.
Opozorila
- Samo v nevtralnem atomu je atomsko število enako številu elektronov. Ion vsebuje različno število elektronov. Če ima ion naboj -1, ima en dodaten elektron. Naboj -2 ima dva dodatna elektrona itd.