Avtor:
Lewis Jackson
Datum Ustvarjanja:
5 Maj 2021
Datum Posodobitve:
1 Julij. 2024

Vsebina
Mol je standardna merska enota v kemiji, ki se uporablja za pregled različnih elementov v spojini. Običajno se masa spojine izračuna v gramih (g) in jo je treba pretvoriti v molske enote. Prehod je precej preprost, vendar moramo še vedno upoštevati nekaj pomembnih korakov. S pomočjo spodnje metode lahko grame enostavno pretvorite v mole.
Koraki
1. del 2: Izračunajte molekulsko maso
Pripravite potrebne zaloge za reševanje matematičnega problema. Ko boste imeli na voljo vsa orodja, boste težavo lažje rešili. Kar potrebujete je:
- Svinčnik in papir. Matematika postane lažja, ko vse zapišete na papir. Predložiti morate vse korake, da dosežete največjo možno oceno.
- Periodni sistem kemijskih elementov: uporablja se za določanje masnih atomov elementov.
- Žepni kalkulator: uporablja se za izračun zapletenih števil.

Ugotovite, kateri elementi so v spojini, ki jo morate pretvoriti v molarne enote. Prvi korak pri izračunu molekulske mase je določitev elementov, ki sestavljajo spojino. To je enostavno, ker je okrajšava za elemente le en do dva znaka.- Če je snov okrajšana z dvema črkama, bo prva črka napisana z veliko začetnico, druga pa z malimi črkami. Primer: Mg je okrajšava za element magnezij.
- Spojine NaHCO3 je sestavljen iz štirih elementov: natrija (Na), vodika (H), ogljika (C) in kisika (O).
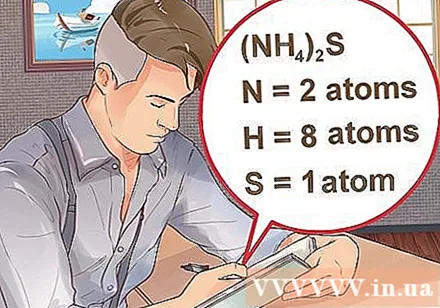
Določite število atomov za vsak element v spojini. Za izračun masne molekule te spojine morate poznati atomsko število vsake snovi v spojini. Majhno število poleg okrajšave elementa predstavlja atomsko številko elementa.- Primer: spojina H2O ima dva atoma vodika in en atom kisika.
- Če je spojina napisana v oklepajih, ki ji je priložen majhen indeks, to pomeni, da vsaka sestavina v oklepajih pomnoži indeks. Primer: spojina (NH4)2S je sestavljen iz dveh atomov N, osmih atomov H in enega atoma S.

Za vsak element zapišite kubični atomski papir. Uporaba periodnega sistema je najlažji način za iskanje kubičnega atoma elementa. Ko poiščete element v periodnem sistemu, boste videli atomsko maso tik pod ikono elementa.- Kubični atom kisika je na primer 15,99.
Izračunajte molekulsko maso. Masna molekula snovi je enaka številu atomov vsakega elementa, pomnoženemu z masnim atomom tega elementa. Ta količina je bistvena za pretvorbo grama v molar.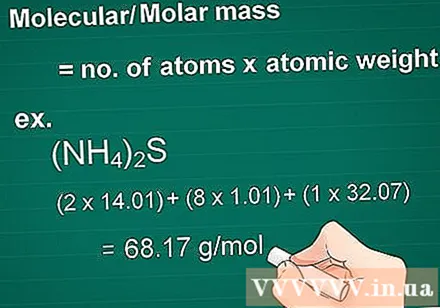
- Najprej pomnožite atomsko število vsakega elementa v spojini z masnim atomom.
- Nato skupaj dodajte mase elementov v spojini.
- Primer: Molekulska masa spojine (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molekulska masa je znana tudi kot molska masa.
Del 2 od 2: Pretvorite grame v mol
Nastavite formulo za pretvorbo. Če želite poiskati število molov spojine, delite število gramov spojine z molsko maso te spojine.
- Formula: število molov = masa (grami) / molska masa spojine (gram / mol)
Številke nadomestite v formulo. Po nastavitvi prave formule je naslednji korak zamenjava številk, ki ste jih izračunali v formulo. Če se želite prepričati, da so podatki v pravilnem položaju, jih lahko preverite tako, da potisnete enoto. Če so po enostavnosti preostala enota moli, ste pravilno nastavljeni.
Reši enačbo. S pomočjo kalkulatorja maso razdelimo na kubično molekulo snovi ali spojine. Količnik bo število molov snovi ali spojine, ki jo iščete.
- Na primer, težava je v 2 g vode (H2O) in vas prosimo, da ga pretvorite v molarne enote. Imamo molsko maso H2O je 18g / mol. Delite 2 z 18, tako da imate 0,1111 mol H2O.
Nasvet
- Ne pozabite vključiti elementa ali imena sestavine med odgovore.
- Če ste pozvani, da predstavite vajo ali kviz, svoje odgovore jasno prikažite tako, da obkrožite ali narišete okence okoli odgovorov.
Kaj rabiš
- Kemični periodni sistem
- Svinčnik
- Papir
- Računalnik
- Težave s kemijo