Avtor:
Lewis Jackson
Datum Ustvarjanja:
6 Maj 2021
Datum Posodobitve:
1 Julij. 2024
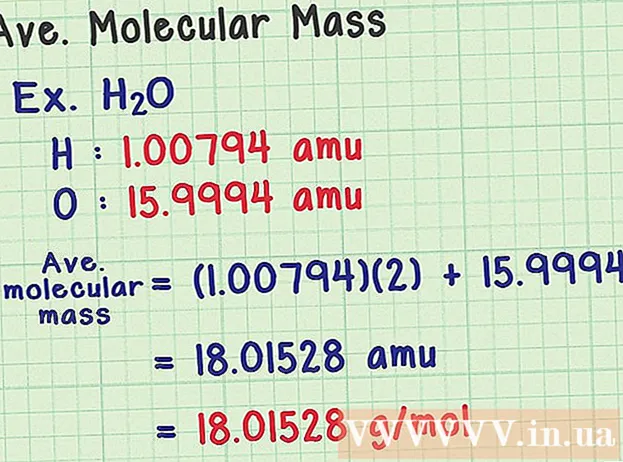
Vsebina
Povprečni masni atom ni neposredna mera mase atoma. Namesto tega je to povprečna masa na atom iz tipičnega vzorca elementa. Če lahko izmerite mase milijard posameznih atomov, lahko to ugotovite z izračunom njihovega povprečja. Imamo bolj praktično metodo, ki temelji na informacijah o različnih izotopih kemičnega elementa.
Koraki
1. del 2: Izračunajte povprečno masno atom
Razumevanje izotopov in masnih atomov. V naravi večina elementov obstaja v številnih oblikah ali izotopih. Edina razlika med dvema izotopoma istega elementa je število nevtronov v atomu, katerih število nevtronov vpliva na masni atom. Izračun povprečne mase atoma upošteva učinek te razlike in vam pove povprečno maso vsakega atoma v vzorcu teh atomov.
- Na primer, element srebro (Ag) ima dva naravna izotopa: Ag-107 in Ag-109 (ali Ag in Ag). Izotop je poimenovan po "masnem številu" ali vsoti števila protonov in števila nevtronov v atomu. To pomeni, da ima Ag-109 dva nevtrona več kot Ag-107, zato je njegov atom nekoliko težji.

Poiščite maso vsakega izotopa. Za vsak izotop potrebujete dva podatka, lahko jih poiščete v referenčnih knjigah ali na spletu, na primer webelements.com. Prva je masni atom ali atomska masa vsakega izotopa. Izotopi z več nevtroni imajo večjo maso.- Na primer, srebrni izotop Ag-107 ima masni atom 106,90509 amu (enota kubičnega atoma). Izotop Ag-109 je nekoliko težji z maso 108,90470.
- Par decimalnih mest na koncu se lahko v dokumentih nekoliko razlikuje. Po masi v oklepajih ne pišite številk.

Zapišite naravno stopnjo preživetja za vsak izotop. To razmerje označuje razširjenost izotopa kot odstotek celotnih atomov elementa. Te podatke lahko najdete v istem dokumentu s kubičnim atomom. Naravno preživetje vseh izotopov mora biti 100% (čeprav se lahko zaradi napake pri zaokroževanju nekoliko razlikuje).- Izotop ag-107 ima razmerje 51,86%. Izotop Ag-109 je manj pogost pri stopnji 48,14%. To pomeni, da ima običajni vzorec srebra 51,86% Ag-107 in 48,14% Ag-109.
- Vsi izotopi, ki nimajo te stopnje preživetja, se prezrejo. Ti izotopi na zemlji ne obstajajo naravno.

Pretvorite odstotek izotopa v decimalno število. Če to razmerje razdelite na 100, dobite enako vrednost kot decimalno mesto.- V zgornjem vzorcu srebra je razmerje izotopov 51,86 / 100 = 0,5186 in 48,14 / 100 = 0,4814.
Poiščite povprečni kubični atom. Povprečni masni atom elementa ima n izotopi enaki (Atomski blokIzotop 1 * razmerjeIzotop 1) + (atomska masaIzotop 2 * razmerjeIzotop 2) + ... + (atomska masaizotopi n * razmerjeizotopi n. To je primer "povprečne mase", kar pomeni, da večja kot je preživetje izotopa, večji je njegov učinek na rezultat. Kako uporabiti to formulo za srebro je naslednje:
- Atom srednje maseAg = (kubični atomAg-107 * razmerjeAg-107) + (atomska masaAg-109 * razmerjeAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Poiščite ta element v periodnem sistemu, da preverite rezultate. Povprečni kubični atom je vedno zapisan pod kemijskim simbolom elementa.
- Atom srednje maseAg = (kubični atomAg-107 * razmerjeAg-107) + (atomska masaAg-109 * razmerjeAg-109)
2. del od 2: Uporaba rezultatov
Pretvori maso v atomsko število. Atom povprečne mase prikazuje razmerje med maso in številom atomov v tipičnem vzorcu tega elementa. To je zelo koristno v kemijskih laboratorijih, ker je skoraj nemogoče natančno prešteti atome, vendar je mase enostavno določiti. Na primer, lahko stehtate vzorec srebra in veste, da bo na vsakih 107.8677 amu en atom srebra.
Pretvori v molsko maso. Enota atomske mase je zelo majhna, zato kemiki pogosto uporabljajo maso grama. Na srečo imamo opredelitve teh konceptov, zato bi morala biti preobrazba enostavna. Samo pomnožite povprečni masni atom z 1 g / mol (molarna konstanta mase), da dobite rezultat v g / mol. Na primer, 107.8677 gramov srebra vsebuje en mol atomov srebra.
Poiščite povprečno molekulsko maso. Ker je molekula zbirka atomov, lahko maso vseh atomov dodate, da poiščete molekulsko maso. Če bi uporabili atom s povprečno maso (namesto mase določenega izotopa), bi bil rezultat povprečna molekulska masa vzorca v naravi. Tu je primer:
- Molekula vode ima kemijsko formulo H2O vsebuje dva atoma vodika (H) in en atom kisika (O).
- Vodik ima povprečni masni atom 1.00794 amu. Kisik ima povprečno atomsko maso 15.9994 amu.
- Torej povprečna molekulska masa H2O je enako (1,00794) (2) + 15,9994 = 18,01528 amu, kar ustreza 18,01528 g / mol.
Nasvet
- Koncept relativne atomske mase se včasih uporablja kot sinonim za povprečni masni atom. Majhna razlika je, ker je atomska masa razmeroma neenotna; gre za merjenje mase glede na atom ogljika-12. Dokler pri izračunu povprečnega kubičnega atoma uporabljate enoto atomske mase, sta ti dve vrednosti enaki.
- Število v oklepajih za kubičnim atomom nam pove napako. Na primer, masni atom 1,0173 (4) pomeni, da ima običajni atom elementa masno območje približno 1,0173 ± 0,0004. Te številke vam ni treba pridobiti, če ni zahtevana.
- V periodnem sistemu je povprečni kubični atom naslednjega elementa večji od tistega pred njim, z redkimi izjemami. Tukaj je hiter način za preverjanje rezultatov.
- 1 enota atomske mase je 1/12 mase atoma ogljika-12.
- Stopnje preživetja izotopov se izračunajo glede na tipične naravne vzorce na zemlji. Snovi, ki se ne pojavljajo v naravi, kot so meteoriti ali tista, proizvedena v laboratoriju, imajo lahko različna razmerja izotopov, zato je tudi povprečni masni atom drugačen.
Opozorilo
- Masni atomi so vedno zapisani v atomskih masnih enotah (amu ali u), včasih imenovanih dalton (Da). Nikoli po tej številki ne pišite nobene enote mase (na primer kilograma), ne da bi jo spremenili.
Kaj rabiš
- Svinčnik
- Papir
- Prenosnik
- Podatki o stopnji preživetja izotopov v naravi.
- Podatki o masni atomski enoti za izotope.



